ここから本文です。
化粧品を初めて製造・製造販売する方へ
「化粧品」については、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」(以下、「医薬品医療機器等法」とします。)で次のとおり定められています。
- 化粧品の定義
- 化粧品の効能の範囲
- 化粧品を製造又は輸入する場合
- 製造販売業とは
- 製造業とは
- 製造販売品目の検討
- 製造販売業の許可申請の流れ
- 製造販売業の許可の要件
- 業者コード登録(製造販売業)
- FD申請(製造販売業)
- 製造販売業許可申請に必要な書類
- 製造業の許可申請の流れ
- 製造業の許可の要件
- 業者コード登録(製造業)
- FD申請(製造業)
- 製造業許可申請に必要な書類
- 製造販売業・製造業の申請書の提出先と手数料
問い合わせ窓口一覧 - 化粧品製造販売業許可を取得した後の流れ
- 参考となるホームページ
1 化粧品の定義
化粧品とは・・・(医薬品医療機器等法第2条第3項)
「化粧品とは、人の身体を清潔にし、美化し、魅力を増し、容貌を変え、又は皮膚若しくは毛髪を健やかに保つために、身体に塗擦、散布その他これらに類似する方法で使用されることが目的とされている物で、人体に対する作用が緩和なもの」をいいます。
例えば、化粧水・香水・口紅などだけでなく、石鹸・シャンプー・ハミガキなども化粧品です。
ただし、これらの使用目的のほかに、人又は動物の疾病の診断・治療又は予防、身体の構造又は機能に影響を及ぼすことを併せて目的としているものや医薬部外品に該当するものは、化粧品ではなく、医薬品や医薬部外品に該当します。
2 化粧品の効能の範囲
化粧品の効能の範囲の改正について(H12年12月28日 医薬発第1339号)
化粧品の効能として認められている範囲は以下のとおりです。
化粧品の効能の範囲
- (1)頭皮、毛髪を清浄にする。
- (2)香りにより毛髪、頭皮の不快臭を抑える。
- (3)頭皮、毛髪をすこやかに保つ。
- (4)毛髪にはり、こしを与える。
- (5)頭皮、毛髪にうるおいを与える。
- (6)頭皮、毛髪のうるおいを保つ。
- (7)毛髪をしなやかにする。
- (8)クシどおりをよくする。
- (9)毛髪のつやを保つ。
- (10)毛髪につやを与える。
- (11)フケ、カユミがとれる。
- (12)フケ、カユミを抑える。
- (13)毛髪の水分、油分を補い保つ。
- (14)裂毛、切毛、枝毛を防ぐ。
- (15)髪型を整え、保持する。
- (16)毛髪の帯電を防止する。
- (17)(汚れをおとすことにより)皮膚を清浄にする。
- (18)(洗浄により)ニキビ、アセモを防ぐ(洗顔料)。
- (19)肌を整える。
- (20)肌のキメを整える。
- (21)皮膚をすこやかに保つ。
- (22)肌荒れを防ぐ。
- (23)肌をひきしめる。
- (24)皮膚にうるおいを与える。
- (25)皮膚の水分、油分を補い保つ。
- (26)皮膚の柔軟性を保つ。
- (27)皮膚を保護する。
- (28)皮膚の乾燥を防ぐ。
- (29)肌を柔らげる。
- (30)肌にはりを与える。
- (31)肌にツヤを与える。
- (32)肌を滑らかにする。
- (33)ひげを剃りやすくする。
- (34)ひげそり後の肌を整える。
- (35)あせもを防ぐ(打粉)。
- (36)日やけを防ぐ。
- (37)日やけによるシミ、ソバカスを防ぐ。
- (38)芳香を与える。
- (39)爪を保護する。
- (40)爪をすこやかに保つ。
- (41)爪にうるおいを与える。
- (42)口唇の荒れを防ぐ。
- (43)口唇のキメを整える。
- (44)口唇にうるおいを与える。
- (45)口唇をすこやかにする。
- (46)口唇を保護する。口唇の乾燥を防ぐ。
- (47)口唇の乾燥によるカサツキを防ぐ。
- (48)口唇を滑らかにする。
- (49)ムシ歯を防ぐ(使用時にブラッシングを行う歯みがき類)。
- (50)歯を白くする(使用時にブラッシングを行う歯みがき類)。
- (51)歯垢を除去する(使用時にブラッシングを行う歯みがき類)。
- (52)口中を浄化する(歯みがき類)。
- (53)口臭を防ぐ(歯みがき類)。
- (54)歯のやにを取る(使用時にブラッシングを行う歯みがき類)。
- (55)歯石の沈着を防ぐ(使用時にブラッシングを行う歯みがき類)。
- (56)乾燥による小ジワを目立たなくする。
注1)例えば、「補い保つ」は「補う」あるいは「保つ」との効能でも可とする。
注2)「皮膚」と「肌」の使い分けは可とする。
注3)( )内は、効能には含めないが、使用形態から考慮して、限定するものである
例えば、「しわを解消する・予防する」、「素肌の若返り効果・老化防止効果」、顔痩せ効果」、「メラニン色素の生成を抑える」等を目的とすることは、化粧品の効能の範囲を逸脱します。
化粧品の効能の範囲は改正されますので最新のものは、厚生労働省法令等データベースサービス(外部サイトへリンク)で確認してください。
化粧品の効能や広告表示については「化粧品等の適正広告ガイドライン(日本化粧品工業連合会)」(外部サイトへリンク)をあわせて確認してください。
3 化粧品を製造又は輸入する場合
化粧品は、医薬品等と同様に「医薬品医療機器等法」で規制されているため、国内製造又は輸入した化粧品を販売・授与するためには、通常、次の許可が必要となります。
また、許可後には、製造販売を行う製品について、市場へ出荷する前に、製造販売届書を提出する必要があります。なお、輸入する製品の場合は、製造販売届書のほか、化粧品外国届書と輸入届書も提出する必要があります。
- 国内の工場で製品を製造して出荷する場合
- (1)化粧品製造業許可(許可区分:一般)
- (2)化粧品製造販売業許可
- 海外から輸入した製品に、法定事項を表示して出荷する場合
- (1)化粧品製造業許可(許可区分:包装・表示・保管)
- (2)化粧品製造販売業許可
4 製造販売業とは
製造販売とは・・・(医薬品医療機器等法第2条第13項)
製造販売とは、「製造等(他に委託して製造する場合を含み、他から委託を受けて製造する場合を含まない。)をし、又は輸入した医薬品(原薬たる医薬品を除く。)、医薬部外品、化粧品又は医療機器をそれぞれ販売し、賃貸し、又は授与すること」をいいます。
- 製品についての流通責任を負う者です。
- 品質(製造)だけでなく、安全(情報)についても積極的に収集・分析・評価を行い、必要な措置を逐次講ずることが求められます。
- 「製造販売業許可」は、製品を市場に出荷(卸売業者や消費者に販売・賃貸・授与)するための許可ですので、この許可では製造(包装・表示・保管のみを行う場合を含む)することはできません。
5 製造業とは
製造販売業者の委託を受け、製品を製造する者です。
- 製造した製品は、製造販売業者又は製造業者にのみ販売・賃貸・授与することができます。
- 製造行為を委託する場合は、委託先は該当する区分の製造業の許可(登録)を受けることが必要です。
- 「製造業許可」は、製品の製造を行うための製造所ごとの許可(登録)ですので、この許可では製品を市場に出荷することができません。
- 保管のみ(最終製品の保管を除く)を行う製造所の場合は、許可ではなく登録となります。
製造業の区分(医薬品医療機器等法第13条、第13条の2の2、施行規則第26条第3項)
| 区分 | 内容 | |
|---|---|---|
|
(1) |
化粧品の製造工程の全部又は一部を行うもの((2)に掲げるものを除く) |
|
| (2) 包装・表示・保管 |
化粧品の製造工程のうち、包装・表示・保管のみを行うもの |
|
6 製造販売品目の検討
- 化粧品の定義にあっているか
製造販売しようとしている品目が前述の化粧品の定義にあっているかを確認する必要があります。 - 効能効果の範囲内であるか
製造販売しようとしている品目の効能効果が前述の化粧品として認められている効能効果の範囲内であるかを確認する必要があります。 - 配合成分に関する基準等にあっているか
医薬品医療機器等法第42条基準
医薬品医療機器等法第42条第2項の規定に基づき、薬事・食品衛生審議会の意見を聞いて、厚生労働大臣は化粧品の性状、品質等に関し必要な基準を設けています。
- 化粧品基準(PDF:94KB)(H12年9月29日 厚生省告示第331号)
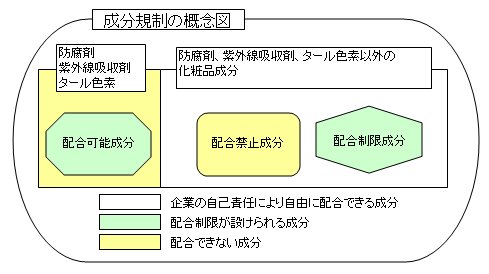
化粧品への「防腐剤、紫外線吸収剤及びタール色素以外の成分の配合の禁止・配合の制限「ネガティブリスト」及び防腐剤、紫外線吸収剤及びタール色素の配合の制限「ポジティブリスト」が定められています。
基準の規定に違反しない成分については、企業責任のもとに安全性を確認し、選択した上で配合できます。
ただし、添加剤としてのみ使用される成分を除く医薬品の成分を配合してはなりません。
(注意)
化粧品基準は改正されますので、必ず厚生労働省法令等データベースシステム等で最新の内容をご確認ください。
また、化粧品基準のイメージ図は、下記をご覧下さい。
- 生物由来原料基準(外部サイトへリンク)(H15年5月20日 厚生労働省告示第210号)
医薬品・医薬部外品・化粧品及び医療用具に使用される人その他の生物(植物除く)に由来する原料・材料(添加剤,培地等製造工程で使用されるものを含む)について品質,有効性及び安全性の確保のため製造に使用される際に講ずべき必要な基準が定められています。
医薬品医療機器等法第56条(販売、製造等の禁止)
医薬品医療機器等法第56条 法第62条(化粧品で準用)
次の各号のいずれかに該当する医薬品は、販売し、授与し、又は販売若しくは授与の目的で製造し、輸入し、貯蔵し、若しくは陳列してはならない。
- 一 日本薬局方に収められている医薬品であつて、その性状又は品質が日本薬局方で定める基準に適合しないもの
- 二 第14条又は第19条の2の規定による承認を受けた医薬品であつて、その成分若しくは分量(成分が不明のものにあつては、その本質又は製造方法)又は性状若しくは品質がその承認の内容と異なるもの(第14条第10項(第19条の2第5項において準用する場合を含む。)の規定に違反していないものを除く。)
- 三 第14条第1項又は第23条の2第1項の規定により厚生労働大臣が基準を定めて指定した医薬品であつて、その成分若しくは分量(成分が不明のものにあつては、その本質又は製造方法)又は性状若しくは品質がその基準に適合しないもの
- 四 第42条第2項の規定によりその基準が定められた医薬品であつて、その基準(第62条において準用する52条第三号及び第61条第六号に規定する基準を除く。)に適合しないもの
- 五 その全部又は一部が不潔な物質又は変質若しくは変敗した物質から成つている医薬品
- 六 異物が混入し、又は付着している医薬品
- 七 病原微生物その他疾病の原因となるものにより汚染され、又は汚染されているおそれがある医薬品
- 八 着色のみを目的として、厚生労働省令で定めるタール色素以外のタール色素が使用されている医薬品
- 医薬品等に使用することができるタール色素を定める省令(PDF:4,028KB)(S41年8月31日 厚生省令第30号)
化粧品に使用できるタール色素が定められています。
化粧品に使用できるタール色素は改正されますので最新のものは、厚生労働省法令等データベースサービス(外部サイトへリンク)で確認してください。
「消費者への必要な情報提供を確保した上で、消費者の需要の多様化に対応したより多くの選択を可能にする」という方向で化粧品基準が定められ、配合成分に関する規制が緩和されてきました。
化粧品に配合する成分については、製造販売業者の責任において安全性を十分に確認した上で、配合の適否を判断してください。
また、配合した成分及び製品の安全性に関する資料を収集、作成及び保管してください。
7 製造販売業の許可申請の流れ
製造販売業の許可申請の流れについては、以下のとおりです。

8 製造販売業の許可の要件
次の3つの要件を満たさなければなりません。
1.人的要件
申請者の資格(医薬品医療機器等法第12条の2)
(法人であるときは、化粧品の製造販売に関する業務を行う役員を含む)
医薬品医療機器等法第5条第3号のイ~へに該当しない者であること
- イ 第七十五条第一項の規定により許可を取り消され、取消しの日から三年を経過していない者
- ロ 第七十五条の二第一項の規定により登録を取り消され、取消しの日から三年を経過していない者
- ハ 禁錮以上の刑に処せられ、その執行を終わり、又は執行を受けることがなくなつた後、三年を経過していない者
- ニ イからハまでに該当する者を除くほか、この法律、麻薬及び向精神薬取締法、毒物及び劇物取締法(昭和二十五年法律第三百三号)その他薬事に関する法令で政令で定めるもの又はこれに基づく処分に違反し、その違反行為があつた日から二年を経過していない者
- ホ 成年被後見人又は麻薬、大麻、あへん若しくは覚醒剤の中毒者
- ヘ 心身の障害により薬局開設者の業務を適正に行うことができない者として厚生労働省令で定めるもの
総括製造販売責任者の設置(医薬品医療機器等法第17条第1項)
医薬品医療機器等法施行規則第85条第2項に該当する者であること
化粧品の総括製造販売責任者の資格については、以下のいずれかに該当する者です。
- 一 薬剤師
- 二 旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する専門の課程を修了した者
- 三 旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する科目を修得した後、医薬品、医薬部外品又は化粧品の品質管理又は製造販売後安全管理に関する業務に三年以上従事した者
- 四 厚生労働大臣が前三号に掲げる者と同等以上の知識経験を有すると認めた者
品質保証責任者の設置
GQP省令(正式名称:医薬品、医薬部外品、化粧品及び再生医療等製品の品質管理の基準に関する省令(平成16年厚生労働省令第136号))第17条に該当する者であること
- ア 品質管理業務を適性かつ円滑に遂行しうる能力を有する者であること。
- イ 化粧品の販売に係る部門に属する者でないことその他品質管理業務の適性かつ円滑な遂行に支障を及ぼすおそれがない者であること。
安全管理責任者の設置
GVP省令(正式名称:医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準に関する省令(平成16年厚生労働省令第135号))第15条で準用する第13条第2項に該当する者であること
- ア 安全確保業務を適性かつ円滑に遂行しうる能力を有する者であること。
- イ 化粧品の販売に係る部門に属する者でないことその他安全確保業務の適性かつ円滑な遂行に支障を及ぼすおそれがない者であること。
上記の総括製造販売責任者、品質保証責任者及び安全管理責任者については、同一所在地に勤務するものであって、それぞれの業務に支障を来さない等、兼務をすることに合理性がある範囲において、三者が兼務することは可能です。
2.GQP(Good Quality Practice)省令への適合
GQP省令(医薬品、医薬部外品、化粧品及び医療機器の品質管理の基準に関する省令(平成16年厚生労働省令第136号))第3章に適合すること
GQP省令の概要については、こちらをご覧ください。
3.GVP(Good Vigilance Practice)省令への適合
医薬品、医薬部外品、化粧品及び医療機器の製造販売後安全管理の基準に関する省令(平成16年厚生労働省令第135号)第4章に適合すること
GVP省令の概要については、こちらをご覧ください。
9 業者コード登録
初めて医薬品等の製造販売業又は製造業の許可を取得しようとする場合は、許可申請の前に業者コードを取得する必要があります。
業者コードは、業者コード登録票に必要事項を記載の上、原則としてe-Gov電子申請サービス(https://shinsei.e-gov.go.jp/)を利用し、医薬品、医薬部外品、化粧品に係る業者は厚生労働省医薬・生活衛生局医薬品審査管理課宛て、医療機器、体外診断用医薬品又は再生医療等製品に係る業者は厚生労働省医薬・生活衛生局医療機器審査管理課に提出してください。
なお、e-Gov電子申請サービスにより難い場合はFAX(医薬品審査管理課:03-3597-9535、医療機器審査管理課:03-3597-0332)により提出してください。
業者コード登録票(ワード:34KB)、業者コード変更登録票(ワード:18KB)
10 FD申請
医薬品等電子申請(FD申請)をお願いします。
「情報の効率化・共有化、事務の進行管理・審査の効率化、迅速な情報提供」を目的として、申請者にFD申請を推奨しています。
FD申請ソフトについては、厚生労働省のホームページからダウンロードできますので、ご活用いただきFD申請にご協力をお願いします。
なお、ソフトは最新版をご使用ください。
(ホームページ)https://web.fd-shinsei.go.jp/(FD申請)(外部サイトへリンク)
(ヘルプデスク)厚生労働省ソフトの操作上の問題点については、ヘルプデスクが対応しますので、FAX又はE-mailでお問い合わせ下さい。
FAX:03-3507-0114
E-mail:fd_iyaku@pmda.go.jp
11 製造販売業許可申請に必要な書類
|
提出書類 |
必須 |
省略 |
様式 |
|
|---|---|---|---|---|
|
1 |
製造販売業許可申請書 |
|
FD申請のホームページより申請ソフトをダウンロードの上、入力し作成してください。https://web.fd-shinsei.go.jp/(FD申請)(外部サイトへリンク) |
|
|
2 |
登記事項証明書(法人の場合。発行日より6ヶ月以内のもの) |
|
注1 |
|
|
3 |
申請者及び業務を行う役員の医師の診断書又は疎明書(発効日より3ヶ月以内のもの) |
原則不要 |
|
診断書[申請時に法人名と併記する代表者は必須] |
|
4 |
組織図(法人の場合) |
原則不要 |
組織図(記載例: |
|
|
5 |
総括製造販売責任者の雇用契約書の写し又は使用関係証明書 |
|
注1 |
|
|
6 |
総括製造販売責任者の資格を証する書類(卒業証書の写し注2又は卒業証明書等、従事証明書) |
|
注1 注2 |
|
|
7 |
品質管理及び製造販売後管理に係る体制に関する書類 |
|
組織図(記載例: |
|
|
8 |
化粧品製造販売業品目一覧表 |
|
化粧品製造販売業品目一覧表 |
(注1)既に同一の書類を宮城県保健福祉部に提出している場合は、省略可。省略する場合は、省略する旨及び省略する書類名、それらが添付されている申請書の種類と提出年月日、業許可番号を備考欄に記載して下さい。
(注2)卒業証書の写しの場合、受付時に原本照合をするので、原本も必ず持参して下さい。
12 製造業の許可申請の流れ
製造業の許可申請の流れについては、以下のとおりです。

13 製造業の許可の要件
次の2つの要件を満たさなければなりません。
- 人的要件(申請者及び責任技術者)
- 物的要件(製造所の構造設備基準)
1.人的要件(医薬品医療機器等法第13条第4項第2号)
申請者の資格
(法人であるときは、化粧品の製造に関する業務を行う役員を含む)
医薬品医療機器等法第5条第3号のイ~へに該当しない者であること
- イ 第七十五条第一項の規定により許可を取り消され、取消しの日から三年を経過していない者
- ロ 第七十五条の二第一項の規定により登録を取り消され、取消しの日から三年を経過していない者
- ハ 禁錮以上の刑に処せられ、その執行を終わり、又は執行を受けることがなくなつた後、三年を経過していない者
- ニ イからハまでに該当する者を除くほか、この法律、麻薬及び向精神薬取締法、毒物及び劇物取締法(昭和二十五年法律第三百三号)その他薬事に関する法令で政令で定めるもの又はこれに基づく処分に違反し、その違反行為があつた日から二年を経過していない者
- ホ 成年被後見人又は麻薬、大麻、あへん若しくは覚醒剤の中毒者
- ヘ 心身の障害により薬局開設者の業務を適正に行うことができない者として厚生労働省令で定めるもの
責任技術者の設置(医薬品医療機器等法第17条第5項)
医薬品医療機器等法施行規則第91条第2項に該当する者であること
化粧品の責任技術者の資格については、以下のいずれかに該当する者です。
- 一 薬剤師
- 二 旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する専門の課程を修了した者
- 三 旧制中学若しくは高校又はこれと同等以上の学校で、薬学又は化学に関する科目を修得した後、医薬品、医薬部外品又は化粧品の製造に関する業務に三年以上従事した者
- 四 厚生労働大臣が前三号に掲げる者と同等以上の知識経験を有すると認めた者
2.物的要件(医薬品医療機器等法第13条第4項第1号)
薬局等構造設備規則(昭和36年厚生省令第2号)に適合すること。
「一般区分」:薬局等構造設備規則第13条
一般区分の化粧品の構造設備の基準は、次のとおりです。
- 一 当該製造所の製品を製造するのに必要な設備及び器具を備えていること。
- 二 作業所は、次に定めるところに適合するものであること。
- イ 換気が適切であり、かつ、清潔であること。
- ロ 常時居住する場所及び不潔な場所から明確に区別されていること。
- ハ 作業を行うのに支障のない面積を有すること。
- ニ 防じん、防虫及び防そのための構造又は設備を有すること。
- ホ 床は、板張り、コンクリート又はこれらに準ずるものであること。
- ヘ 廃水及び廃棄物の処理に要する設備又は器具を備えていること。
- 三 製品、原料及び資材を衛生的に、かつ、安全に貯蔵するために必要な設備を有すること。
- 四 製品等及び資材の試験検査に必要な設備及び器具を備えていること。ただし、当該製造業者の他の試験検査設備又は他の試験検査機関を利用して自己の責任において当該試験検査を行う場合であつて、支障がないと認められるときは、この限りでない。
「包装・表示・保管区分」:薬局等構造設備規則第13条の2
包装・表示・保管区分の化粧品の構造設備基準は次のとおりです。
- 一 製品等及び資材を衛生的かつ安全に保管するために必要な構造及び設備を有すること。
- 二 作業を適切に行うのに支障のない面積を有すること。
- 三 製品等及び資材の試験検査に必要な設備及び器具を備えていること。ただし、当該製造業者の他の試験検査設備又は他の試験検査機関を利用して自己の責任において当該試験検査を行う場合であつて、支障ないと認められるときは、この限りでない。
14 業者コード登録
初めて医薬品等の製造販売業又は製造業の許可を取得しようとする場合は、許可申請の前に業者コードを取得する必要があります。
業者コードは、業者コード登録票に必要事項を記載の上、原則としてe-Gov電子申請サービス(https://shinsei.e-gov.go.jp/)を利用し、医薬品、医薬部外品、化粧品に係る業者は厚生労働省医薬・生活衛生局医薬品審査管理課宛て、医療機器、体外診断用医薬品又は再生医療等製品に係る業者は厚生労働省医薬・生活衛生局医療機器審査管理課に提出してください。
なお、e-Gov電子申請サービスにより難い場合はFAX(医薬品審査管理課:03-3597-9535、医療機器審査管理課:03-3597-0332)により提出してください。
業者コード登録票(ワード:34KB)、業者コード変更登録票(ワード:18KB)
15 FD申請
医薬品等電子申請(FD申請)をお願いします。
「情報の効率化・共有化、事務の進行管理・審査の効率化、迅速な情報提供」を目的として、申請者にFD申請を推奨しています。
FD申請ソフトについては、厚生労働省のホームページからダウンロードできますので、ご活用いただきFD申請にご協力をお願いします。
なお、ソフトは最新版をご使用ください。
(ホームページ)https://web.fd-shinsei.go.jp(FD申請)(外部サイトへリンク)
(ヘルプデスク)厚生労働省ソフトの操作上の問題点については、ヘルプデスクが対応しますので、FAX又はE-mailでお問い合わせ下さい。
FAX:03-3507-0114
E-mail:fd_iyaku@pmda.go.jp
16 製造業許可申請に必要な書類
|
提出書類 |
必須 |
省略 |
様式 |
|
|---|---|---|---|---|
|
1 |
製造業許可申請書 |
|
FD申請のホームページより申請ソフトをダウンロードの上、入力し作成してください。https://web.fd-shinsei.go.jp/(FD申請)(外部サイトへリンク) |
|
|
2 |
登記事項証明書(法人の場合。発行日より6ヶ月以内のもの) |
|
注1 |
|
|
3 |
申請者及び業務を行う役員の医師の診断書又は疎明書(発効日より3ヶ月以内のもの) |
原則不要 |
|
診断書[申請時に法人名と併記する代表者は必須] |
|
4 |
組織図(法人の場合) |
原則不要 |
||
|
5 |
責任技術者の雇用契約書の写し又は使用関係証明書 |
|
注1 |
|
|
6 |
責任技術者の資格を証する書類(卒業証書の写し注2又は卒業証明書等、従事証明書) |
|
注1 注2 |
|
|
7 |
構造設備の概要の一覧表 |
|
構造設備の概要の一覧表 |
|
|
8 |
付近の見取り図 |
|
||
|
9 |
建物の配置図及び製造所の平面図 |
|
注1 |
|
|
10 |
製造設備・器具の一覧表 |
|
製造設備・器具の一覧表 |
|
|
11 |
試験検査設備の一覧表 |
|
試験検査設備の一覧表 (試験検査用機械器具一覧表ワードファイル(ワード:50KB)、試験検査用機械器具一覧表PDFファイル(PDF:56KB)) |
|
|
12 |
他の機関等の利用概要 |
|
注1 |
他の機関等の利用概要 |
|
13 |
利用する施設の図面 |
|
注1 |
|
|
14 |
利用する施設の試験検査設備の一覧表 |
|
注1 |
|
|
15 |
利用する施設との利用関係証明書 |
|
注1 |
|
|
16 |
化粧品製造業品目一覧表 |
|
化粧品製造品目一覧表 |
(注1)既に同一の書類を宮城県保健福祉部に提出している場合は、省略可。省略する場合は、省略する旨及び省略する書類名、それらが添付されている申請書の種類と提出年月日、業許可番号を備考欄に記載して下さい。
(注2)卒業証書の写しの場合、受付時に原本照合をするので、原本も必ず持参して下さい。
17 製造販売業・製造業の申請書の提出先と手数料
|
区分 |
手数料 |
|---|---|
|
化粧品製造販売業 |
61,200円 |
|
化粧品製造業(一般) |
43,200円 |
|
化粧品製造業(包装・表示・保管) |
31,800円 |
| 化粧品製造業(特定保管) | 27,600円 |
問い合わせ窓口一覧
申請や相談等で来られる方は、事前に担当者の予約を取っていただきますようお願いします。
問い合せ窓口が薬務課の場合、ネット予約を受け付けております。
18 化粧品製造販売業許可を取得した後の流れ
19 参考となるホームページ
<参考ホームページ>
- 東京都のホームページ
化粧品の表示等について:http://www.tokyo-eiken.go.jp/k_yakuji/i-kanshi/cosme/c_label/(外部サイトへリンク) - 大阪府のホームページ
化粧品の製造販売業と製造業について:http://www.pref.osaka.jp/yakumu/shinsa/hathucosume.html(外部サイトへリンク) - 厚生労働省(外部サイトへリンク)のホームページ
法令等データベースシステム:http://wwwhourei.mhlw.go.jp/hourei/index.html(外部サイトへリンク) - 日本化粧品工業連合会(外部サイトへリンク)のホームページ
粧品の全成分表示の際に使用する「表示名称」が検索ができます。
お問い合わせ先
より良いウェブサイトにするためにみなさまのご意見をお聞かせください
重要なお知らせ
こちらのページも読まれています
同じカテゴリから探す
- 医薬品医療機器等法に係る販売業者閲覧用台帳
- 薬局
- 向精神薬試験研究施設設置者の製造量等の年間報告
- フェンタニル等乱用薬物の早期検出及び拡大防止のための情報提供について
- 市販薬のオーバードーズ(過量摂取)について
- 薬局取扱処方箋数届出
- 残留限度値を超える麻薬成分が検出された製品に対する注意喚起について
- 指定薬物を含有する危険ドラッグの発見について
- 覚醒剤取締法に基づく各種指定申請について
- 残留限度値を超える麻薬成分が検出された製品について(清涼飲料水)
- 廃止届
- 医療機器販売業・貸与業
- 高度管理医療機器等販売業・貸与業許可申請
- 麻薬・向精神薬・覚醒剤(原料)・大麻
- 問い合わせ窓口
- 医薬品販売業
- 医薬品等の適正使用の推進等に関すること
- 温泉法関係手続きの様式
- 医薬品,医療機器等製造販売業・製造業許可(登録)申請(医薬品医療機器等法)
- 認定薬局の認定申請
- 認定薬局の認定更新申請
- 高度管理医療機器等許可更新申請
- 許可証の書換交付・再交付申請
- 認定証の書換交付・再交付申請
- 販売従事登録申請について
- 8.フィブリノゲン製剤を投与された方々に対するお知らせ
- 販売従事登録証の書換え交付申請について
- 登録販売者名簿登録事項変更届について
- 販売従事登録の消除申請について
- 販売従事登録証の再交付申請について
- 登録販売者の手続き等について
- 化粧品製造販売業及び製造業問い合わせ窓口一覧
- 化粧品を初めて製造・製造販売する方へ
- 本県の薬物乱用対策について
- 毒物劇物営業
- 高度管理医療機器販売業・貸与業に関する変更届
- 管理医療機器販売業・貸与業に関する変更届
- 毒物劇物取扱,毒物劇物営業
- 残留限度値を超える麻薬成分が検出された製品について
- 覚醒剤取締法関係申請書等様式ダウンロードサービスページ
- ワクチン等緊急医薬品の入手方法について
- 宮城県薬事審議会
- 令和6年度毒物劇物一般・特定品目販売業者研修会について
- 医療用解熱鎮痛薬等の安定供給について
- 麻薬及び向精神薬取締法関係申請書等様式ダウンロードサービスページ
- 麻薬譲受証・麻薬譲渡証について
- 所有麻薬届・麻薬譲渡届
- 麻薬の廃棄の手続き
- 麻薬小売業者間譲渡許可
- 災害時薬事関連業務マニュアル